RESUMO - Objetivou-se com este estudo analisar a morfologia placentária de fêmeas asininas, espécie, cuja importância no meio rural é de inestimável valor, sendo poucas as informações detalhadas sobre sua placenta, “órgão” imprescindível à viabilidade fetal e a interação materno-fetal, mediante estudo macroscópico, microscópico e de microscopia eletrônica de varredura, os quais, exceto a macroscopia, foram realizados também na interação materno-fetal (útero-placentária). Para tanto, utilizaram-se onze fêmeas desta espécie e foram colhidas 11 placentas logo após a parição a campo, no instante de sua liberação, além de fragmentos de uma placenta oriunda de uma dessas 11 fêmeas, que teve sua gestação acompanhada por duas vezes. Assim, na primeira delas realizou-se operação cesariana e fragmentos da interação materno-fetal foram colhidos; parte deles fixados para posterior processamento usual em histologia e, outra parte, fixada e processada para análise à microscopia eletrônica de varredura. Sua segunda gestação foi acompanhada até o momento da parição e a liberação da placenta após parto normal, sendo colhida na íntegra. Após a colheita, as onze placentas foram pesadas, analisadas macroscopicamente e alguns fragmentos placentários fixados para subseqüente processamento usual em histologia; outros fragmentos foram fixados convenientemente para posterior processamento à microscopia eletrônica de varredura. Das peças analisadas e das preparações microscópicas e ultraestruturais, foram realizadas fotografias, fotomicrografias e ultrafotografias para a documentação. Verificou-se que o valor médio dos pesos dos jumentos, como os pesos das placentas, em relação aos neonatos foi de 8.36.1.10 e 13,18% respectivamente. A microscopia de luz e microscopia eletrônica de varredura
foram observados os vilos coriônicos interdigitando-se às criptas endometriais, formando os microplacentônios; além das áreas areolares e arcadas, glândulas endometriais e membrana corion-alatóide coberta por tufos vilosos, apresentando similaridade com estudos feitos em outra raça de jumentos e éguas.
Palavras-Chave: Placenta, Interação Materno-Fetal, Jumenta.
I. INTRODUÇÃO
Há séculos, os equídeos estão muito ligados ao homem. Desde tempos
distantes, quando os cavalos eram utilizados nas batalhas, até os nossos dias, esse nobre animal, faz-se cada vez mais presente, participando, colaborando, somando e potencializando a capacidade e as façanhas humanas, seja nas mais humildes tarefas ou em importantes competições.
E os asininos? E os muares? Que lugar ocupam nessa era tecnológica? Os muares, em épocas remotas, foram utilizados simultaneamente nos meios rurais, sendo a força de tração nas tarefas agrícolas e ainda meio de transporte. Do “Brasil Colônia”, dos engenhos até nossos dias, mais do que nunca eles se fazem presentes. Haja vista o grande impulso na agricultura familiar, tão propagada, por servir até mesmo como alavanca na política eleitoreira; os muares servem como principal força de tração desse seguimento social que ora se firma como expressão nacional. Ainda há outro nicho, onde os muares, a chamada “tropa de patrão”, tem forte representação nas montarias de elite, cavalgadas, concursos de marcha e andamento (marcha picada ou batida), sendo comercializado por cifras altíssimas.
A tropa de “peão”, que são burros e mulas destinadas ao serviço do campo “ na lida do gado”, se faz presente em todo território nacional.
Então, qual é a importância dos asininos? – É imensa, sem os quais não teríamos os muares, tão necessários e insubstituíveis, pela sua resistência, força e adaptação em qualquer clima solo e vegetação.
Os jumentos chegaram ao Brasil, por volta de 1534, pelo porto de São VicenteSP, oriundos da África e trazidos por colonos portugueses e foram enviados a Pernambuco, onde encontraram ambiente favorável para se reproduzirem rapidamente.
A principal região de criação de jumentos instalou-se em Minas Gerais, nos séculos XVIII e XIX, onde eram necessários à mineração. A partir do século XIX, o Brasil importou jumentos da Espanha, da Itália e da França, com a finalidade de aprimoramento de raça (ABCJ PÊGA, 2008).
A seguir estão descritas informações exaradas pelo Professor Otávio Domingues no jornal da Associação Brasileira dos Criadores de Jumento Pêga (ABCJ PÊGA, 2008).
“Assim, a presença de uma estirpe de asininos em uma região de Minas Gerais constitui fato que não pode causar estranheza a nenhum estudioso de tais assuntos. Os criadores mineiros demonstravam, por força das circunstâncias, aliadas ao seu reconhecido conservadorismo, uma tendência para formação de raças locais, a tal ponto que podemos considerar esta característica como uma daquelas a distinguir o povo montanhês das demais populações brasileiras”.
Por ser a produção de muares uma necessidade para a indústria de mineração, nos séculos XVIII e XIX, era natural que se estabelecesse, nos vales mineiros, uma criação de asininos para produção de muares. Tais asininos seriam forçosamente de procedência IBÉRICA, pois naquela época o provimento das nossas necessidades, nesse terreno, teve ali sua origem mais pronta e natural.
Estudando-se os jumentos selecionados pelos criadores mineiros, não será difícil optar pela hipótese de que seu tronco étnico originário é o Equus asinus africanus, do qual muito se aproximam.
A raça Egípcia é aquela que se acha menos longe do jumento Pêga (mineiro), e dois são os pontos de contato indiscutível: 1. A ocorrência da pelagem branca, frequente no jumento Egípcio e que nenhuma outra variedade de jumento apresenta, seja do Equus asinus africanus ou do Equus asinus europeus. 2. A presença de sinais como estrela e extremidades brancas encontradas no jumento Egípcio.
Portanto, no jumento Pêga deparamos com a presença da cor branca, seja na pelagem, seja sob a forma de sinal de fronte ou nos membros, constituindo ponto seguro a considerar no estudo da filiação da raça Pêga. Admitiu-se uma origem mesclada, visto não ser aceitável a introdução exclusiva do tronco Africano. Houve introdução de reprodutores das raças Italiana, Andaluza e Egípcia.
De modo geral, a população asinina brasileira é uma mescla de dois tipos étnicos: Africanus – Europeus.
Entre as raças européias, distinguem-se a poitevina-francesa, a catalã-espanhola e a apuliesa-italiana. No Brasil, a raça brasileira desenvolvida em planteis paulistas é a de melhor qualidade. A raça Pêga foi criada em Minas Gerais e disseminou-se pelo Rio de Janeiro, pelo Espírito Santo e pelo sul da Bahia. A nordestina, muito rústica, encontra-se nas regiões mais áridas do país. O nome Pêga surgiu no município de Lagoa Dourada-MG, onde o rebanho inicial da Fazenda Engenho Grande, adquirido do Padre Torquato, era constituído de dois jumentos e algumas jumentas que, desde então, não deixou penetrar nesse rebanho, outro sangue. Os animais eram marcados com marca do mesmo formato de uma algema que servia para prender escravos e que se chamava “pega”. Então os animais daquela fazenda passaram a ser reconhecidos pela marca Pêga.
Assim o jumento Pêga representa a mescla fixada em raça e enobrecida pelas suas excepcionais qualidades.
Apesar das várias semelhanças entre equinos, asininos e muares, diferenças marcantes devem ser consideradas. Os asininos e equinos têm a seguinte classificação científica: Reino: Animália, Filo: Chordata, Classe: Mammalia, Ordem Perissodactyla, Família: Equidae, Gênero: Equus, Espécie: E. asinus e E. caballus. Nomenclatura binominal, Equus asinus e Equus caballus, Asininos e equinos.
Os cruzamentos entre equinos e asininos resultam em produtos híbridos, quase sempre estéreis e que podem acontecer das seguintes formas: a) Égua (equino) x Jumento (asininos) = burro ou mula. b) Jumento (asinino) x cavalo (equino) bardoto ou bardota, sendo que os burros e mulas são os mais usados em função das suas capacidades peculiares como: força, resistência, capacidade de aprendizado, docilidade e aceitação do homem nessa interação.
Esses híbridos são quase sempre estéreis devido ao fato de o cavalo possuir 64 cromossomos e o jumento 62, resultando em híbrido com 63 cromossomos.
Apesar do número de cromossomos serem diferentes nessas duas espécies animais, o cruzamento entre ambas é possível, devido à similaridade da placenta da égua e da jumenta (SAMUEL et al., 1974; DANTZER & LEISER, 1992).
A forma definitiva da placenta geralmente é determinada pela distribuição inicial do vilo sobre a superfície coriônica, assim, uma placenta é denominada difusa (égua e suínos) quando as vilosidades distribuem-se regularmente pelo córion. Quando estas vilosidades estiverem agrupadas em pequenas zonas desta estrutura, ela é denominada placenta cotiledonária ou múltipla e vai possuir uma carúncula correspondente na mucosa uterina, como é a placenta dos ruminantes. As vilosidades coriônicas dispostas em uma zona ou cinta determinam a placenta zonária, encontrada em muitos carnívoros. Nos primatas, roedores, quirópteros e insetívoros, a disposição circular dos vilos coriônicos determina a placenta discoidal (STRAHL, 1906 ; GROSSER, 1927, WIMSATT, 1962; SCHWARZE E SCHRÖDER, 1970; RAMSEY, 1982; NODEN & DE LAHUNTA ,1990; LEISER E KAUFMANN, 1994; LEME DOS SANTOS, 1996; HAFEZ, 2004).
Assim, considerando-se a importância dos asininos, além da complexa
característica do “órgão placenta” no evento reprodutivo, objetiva-se com este trabalho, estudar e descrever a morfologia da placenta de jumenta e a interação materno-fetal, quanto à constituição macroscópica, microscópica e ultra-estrutural.
II. REVISÃO DA LITERATURA
A palavra “placenta” conota uma justaposição funcional entre tecidos fetais e maternos e as funções placentárias englobam todas as atividades fisiológicas dependentes, direta ou indiretamente, da fusão e da interação entre esses tecidos durante a vida pré-natal. Entre os mamíferos, a grande gama de atividades placentárias realizam-se por meio de um complexo formado por órgãos especializados os quais se desenvolvem, concorrentemente, em seqüência cronológica ou funcional; este padrão varia amplamente nas diferentes espécies, pode ocorrer a presença de órgãos placentários específicos, funcionalmente ativos por toda, ou só em parte da gestação e que também podem ter suas funções alteradas no decorrer da prenhez.
Estas e outras permutações são responsáveis pela incrível complexidade anatômica e fisiológica da placenta entre os mamíferos (WIMSATT,1962). Nos mamíferos, a placenta é um dos órgãos estruturalmente mais complexos.
Essa complexidade é promovida, em parte, pela interação dos tecidos de origem materna e fetal, além da presença de uma variedade de camadas intermediárias que se interpõem entre os leitos vasculares materno e fetal, bem como devido a evolução das relações destes tecidos e das membranas fetais durante o período de implantação do blastocisto até o parto (MOSSMAN, 1987).
Durante a prenhez dos vertebrados vivíparos, estes desenvolvem um sistema complexo de membranas nutricionais que envolvem o feto. No local de aposição ou de união dessas membranas, denominadas membranas fetais, com a mucosa uterina é formada a placenta, com o propósito de promover as trocas materno-fetais (LEISER & KAUFMANN, 1994).
Define-se a placenta como um órgão transitório formado por tecidos maternos e fetais, com a função de transportar substâncias nutritivas do organismo materno para o feto, bem como promover "trocas metabólicas" e desempenhar funções endócrinas quanto à produção de hormônios na manutenção da gestação (LEISER & KAUFMANN, 1994).
Após a fertilização do óvulo pelo espermatozóide e o desenvolvimento do zigoto e seguidas divisões mitóticas até o estágio de blastocisto, este inicia o processo de implantação na mucosa uterina e o embrião passa a apresentar uma extensão de seus folhetos, iniciando a formação dos anexos embrionários (ALMEIDA, 1999; MOORE, & PERSAUD, 2008).
O saco vitelínico, primeiro anexo a ser formado nos mamíferos domésticos, persiste como estrutura rudimentar, sendo precocemente um órgão vasculógeno e hematocitopoético. O âmnion é um envoltório sacular do embrião e do feto, que contém líquido amniótico (impede a desidratação do embrião, permite a motilidade dos tecidos da superfície embrionária e proteção mecânica contra choques e atritos). O alantóide, nos mamíferos é um divertículo endodérmico do intestino posterior que se une ao cório formando a membrana córion-alantoide. Nos equinos e carnívoros, o alantóide desenvolve-se bastante, envolvendo a cavidade amniótica com o feto. O córion, anexo derivado do trofoblasto (o mesoderma extra-embrionário), ao revestir a camada interna do trofoblasto, transforma-o na membrana denominada córion ou serosa.
Posteriormente, esta membrana converte-se em cório secundário, dotado de vilosidades, estabelecendo relações com a mucosa uterina. Enfim, o cordão umbilical, anexo que une o feto à placenta, apresentando no seu interior os vasos alantoideanos (agora chamados umbilicais), representados por duas veias e duas artérias (homem, equino e suíno ocorrem obliteração e desintegração da veia umbilical direita). Pode conter ainda pedículos do saco vitelínico e do alantóide (SCHWARZE E SCHRÖDER, 1970; ALMEIDA, 1999; MOORE, & PERSAUD, 2008).
Nos equídeos é consistentemente presente o hipomane mergulhado no fluido alantóico, mas nunca no fluido amniótico. Caracteriza-se como uma estrutura amorfa, de coloração que varia do branco ao marron e corresponde ao cálculo urinário fetal (WHITWELL & JEFFCOTT, 1975).
A placenta das diferentes espécies exibe uma grande diversidade em estruturas que incluem diferentes organizações, quanto ao tipo celular, forma, e modelo de distribuição sobre o endométrio. Assim a placenta pode ser classificada mediante sua forma, a interdigitação materno-fetal e o grau de separação entre as membranas maternal-fetal (KAUFMANN, 1983).
De uma forma mais complexa LEISER & KAUFMANN, (1994) estabeleceram uma classificação placentária mais ampla, baseando-se nos seguintes aspectos: tipo e número de membranas envolvidas; forma externa do órgão; padrão geométrico da interdigitação das superfícies materna e fetal; tipo e número de camadas teciduais separando o sangue materno e fetal; arranjo geométrico dos vasos materno e fetal para troca de substâncias.
Assim, de acordo com as membranas fetais, classificam-se as placentas do seguinte modo: placenta coriônica, primeiro passo no desenvolvimento da placenta em todos os mamíferos (presente até o final da gestação como uma parte avascular e não especializada na placenta dos primatas); placenta coriovitelínica, membrana coriônica conectada à circulação fetal pelos vasos vitelínicos (menor parte das placentas dos perissodactyla e carnívoros); placenta corioalantóica, membrana coriônica conectada à circulação fetal pelos vasos alantoideanos (placenta da maioria dos mamíferos); placenta vitelínica, epitélio do saco vitelínico com vasos vitelínicos conectados à circulação fetal (peixes, anfíbios e parte da placenta de roedores) (LEISER & KAUFMANN, 1994).
Todas as placentas dos mamíferos aumentam a área de contato entre as superfícies materna e fetal através da forma mais ou menos intensa das interdigitações dos tecidos. Quando esta distribuição se prolonga na maior parte da superfície coriônica temos a placenta difusa (suíno, equino). No entanto, na maioria dos mamíferos, as interdigitações estão concentradas em áreas específicas:
Na placenta cotiledonária: típica nos ruminantes, as interdigitações concentram-se em regiões placentárias (placentomas ou placentônios) separadas por áreas intercotiledonárias do cório liso (estrutura membranosa);
Na placenta zonária: encontrada nos carnívoros, a zona de contato das interdigitações formam um cinto ao redor do saco coriônico;
Na placenta bidiscoidal: o tecido de troca concentra-se em dois discos placentários (macaco Rhesus, marmota e alguns roedores);
Na placenta discoidal: encontrada na maioria dos roedores e no homem, o tecido de troca (interdigitações) se encontra em uma área individualizada, na forma de placa/disco (LEISER & KAUFMANN, 1994).
Quanto aos padrões de interdigitação materno-fetal, as placentas podem ser dos seguintes tipos: Tipo pregueado/dobrado, os sulcos da mucosa uterina são ocupadas pelas interdigitações do cório (suíno); Tipo lamelar, encontrado na placenta dos carnívoros, as interdigitações coriônicas se arranjam em múltiplas dobras; Tipo viloso, encontrado nos ruminantes, nos equinos e primatas superiores; as interdigitações coriônicas projetam-se no tecido uterino na forma de cerdas. Tipo trabecular, misto de tipo lamelar e viloso, condição rara, descrita para alguns macacos do novo mundo como o Callitrix. Tipo labiríntico, tipo mais sofisticado de inter-relação dos tecidos maternofetal, encontrado nos roedores e alguns primatas inferiores, as interdigitações se arranjam como uma rede de canais ou lacunas (LEISER & KAUFMANN, 1994).
Mediante as camadas de tecido inter-hemal, isto é, mediante o tipo e o número de camadas que separam o sangue materno e fetal), teoricamente seis camadas teciduais separam as circulações materna e fetal - endotélio materno, tecido conjuntivo, epitélio maternal, trofoblasto (epitelio coriônico), tecido conjuntivo fetal e endotélio fetal.
Dessa forma as placentas classificam-se em: Placenta epiteliocorial, quando o epitélio coriônico e o endotélio estão preservados, consequente a uma implantação superficial (suíno e equino); Placenta sinoepiteliocorial, verificada nos ruminantes, é semelhante à placenta epiteliocorial, no entanto, algumas células trofoblásticas (também chamadas binucleadas ou células gigantes) se fundem com as células epiteliais uterinas. O Tipo Sindesmocorial é um estágio transitório inicial, anterior à hibridização (mistura) do epitélio uterino e trofoblasto; Placenta endoteliocorial, verificada em carnívoros e alguns morcegos, as células trofoblásticas se insinuam profundamente até o endotélio materno (LEISER & KAUFMANN, 1994).
A classificação placentária, de acordo com o arranjo geométrico dos capilares maternos e fetais e com relação ao fluxo sanguíneo na área de trocas ocorre da seguinte forma: Por fluxo concorrente que é o sistema menos eficiente para realização das trocas entre o sangue materno e o fetal; neste caso, os capilares materno e fetal estão dispostos de forma paralela e o fluxo sanguíneo percorre na mesma direção. Por fluxo contracorrente, onde os capilares materno e fetal estão dispostos de forma paralela, no entanto o fluxo sanguíneo segue em direção oposta; este é o arranjo vascular mais efetivo na difusão passiva. Por fluxo em corrente secundária (cruza a corrente principal), os capilares dispostos de forma perpendicular, apresentam eficiência intermediária quando comparado ao fluxo corrente e contracorrente. Pode ser simples (carnívoros), duplo (primatas primitivos) ou multiviloso (LEISER & KAUFMANN, 1994).
Na placenta da égua, a junção focalizada, é denominada de microplacentônio(microplacentoma), neste local as áreas vilosas do córion-alantoide igam-se ao endométrio de forma difusa resultando em microplacentônios (EURELL, 2004).
A placenta de éguas e jumentas são estruturalmente semelhantes sendo consideradas como difusa, epitéliocorial e microcotiledonária (STEVEN, 1982; LEISER E KAUFMANN, 1994; WOODING E FLINT, 1994; ALLEN E SHORT, 1997; ABDELNAEIM et al., 2006).
A placenta córion-alantóica do equino é classificada como difusa tal qual a dos suínos. Os vilos coriônicos não se apresentam uniformemente distribuídos, formam os tufos vilosos, que penetram no epitélio uterino interdigitando-se às criptas maternas e formando assim, os microplacentônios (microplacentomas), que se estabelecem entre as áreas areolares (RAMSEY, 1982).
As áreas areolares correspondem ao local onde se abrem as glândulas
endometriais, cujas secreções preenchem o espaço areolar, sob a arcada fetal (elevações do trofoblasto) (GINTER, 1992; EURELL, 2004). A aréola é uma estrutura especializada que consistem de parte fetal (alantocórion) e parte materna, incluindo a abertura da glândula uterina. As duas partes são separadas pela cavidade areolar (SABER et al., 2008).
Tanto a placenta da égua quanto a da jumenta, contém dois sistemas
sanguíneos, um de origem materna e outro de origem fetal que são essenciais para a troca de sangue, sendo sugerido para a égua o sistema contra-corrente (ABDELNAEIM, 1998, 2003). Para a jumenta foi verificada uma vascularização placentária mista de fluxo contra-corrente e corrente cruzada (SABER et al., 2008). Ainda ABD- ELNAEIM (1998, 2003) sugerem para a camela o sistema sanguíneo placentário contracorrente.
A placenta da jumenta selvagem da Somália (Equus asinus somalius – Equus africanus somaliensis) é difusa, epitéliocorial, com vilos simples adjacente ao endométrio; não ocorre a invasão do útero pelo trofoblasto, onde foram encontradas células cubóides e uninucleares, não sendo verificadas células binucleadas. Sob a face córion-alantóica o trofoblasto é mais cilíndrico, principalmente entre as vilosidades (BENIRSCHKE, 2004).
Assim como na placenta da égua doméstica e de muitas fêmeas unguladas, na jumenta selvagem da Somália, as células trofoblásticas são cilíndricas e ocasionalmente, grânulos de pigmento amarelo são encontrados inclusos em seu citoplasma. A origem deste pigmento é incerta. Não está associado com hemorragias, como sugere o termo "órgão hemófago", muito discutido na placentação de ovinos. Não se sabe se esse pigmento é derivado da quebra da hemoglobina; há suspeitas de que possa representar a melanina (BENIRSCHKE, 2004).
Quanto às membranas fetais da jumenta selvagem da Somália, o âmnion é constituído por fina camada de tecido conjuntivo com epitélio simples, sendo revestido pela membrana alantóica que contém grande número de vasos sangüíneos; a cavidade formada por ambas as membranas contém a urina fetal e os hippomanes (hipomane) que são estruturas achatadas e marrom e podem permanecer livres ou de forma pedunculada (BENIRSCHKE, 2004).
O Eastern Kiang (Equus kiang) é considerado o maior jumento selvagem e como os demais equídeos, apresentam placenta difusa e epiteliocorial, cujo peso médio é de 3,450 g. (NOWAK, 1999). Toda a superfície deste tipo placentário, segundo AMOROSO (1961) e NOWAK (1999) é coberta com vilosidades curtas e levemente ramificadas, revestidas por uma simples camada de trofoblasto. Não apresenta células binucleadas como os ruminantes. Abaixo da face coriônica e principalmente nos pequenos espaços intervilosos, o epitélio trofoblástico é geralmente, cilíndrico com curtos microvilos e, frequentemente, ocorrem inclusões pigmentares amarelas. AMOROSO (1961) mencionou a presença de gotículas de gordura no citoplasma.
Segundo BENIRSCHKE (2004), na distribuição das vilosidades da placenta do Eastern Kiang, pode-se observar grandes espaços de córion liso, ou apenas pequenas distâncias entre elas. Para este mesmo autor, na placenta desses animais, não foi verificada estrutura semelhante a “cotilédones miniaturas”, conforme referenciou AMOROSO (1961).
Na placenta a termo de éguas jovens primíparas observaram-se a presença de microcotiledones fetais, alargados e bem desenvolvidos, além de vilos fetais longos, cujo formato assemelhava-se ao de uma árvore ramificando-se em várias direções.
Separando-se manualmente a porção fetal da porção materna das placentas eram verificados, macroscopicamente em microcotiledones e tufos distintos dos vilos sobre a face endometrial do alantocórion (ABD-ELNAEIM et al., 2006).
Histologicamente, os microplacentônios (microplacentomas) da jumenta
consistem de uma parte fetal mais clara, os microcotilédones e de uma parte materna mais escura, as microcarúnculas que se interligam, respectivamente, pelos vilos (fetais) e criptas ou septos maternos. A forma dos microplacentônios parece arredondada em projeção bidimensional ou globular mediante observação tridimensional à microscopia eletrônica de varredura. Com o avanço da prenhez, este formato modifica-se para a forma elíptica/ovóide. Formas intermediárias, entre globular e ovóide também podem ser encontradas (SABER et al., 2008).
Verificou-se ainda, em jumentas, que o comprimento dos microplacentônios, mensurados morfometricamente entre o pólo fetal ou base e pólo maternal ou ápice, mostrou aumento gradual com o avanço da prenhez, atingindo 1060 µm em 70 cm de “crown-rump length” (CRL) com placenta a termo. Também houve um aumento no diâmetro da largura, chegando a 1000 µm em 70 cm de “crown-rump length” (CRL) com placenta a termo. Nas placentas de todas as fases, os microcotilédones são diferenciados com relação aos vilos centrais, intemediários e terminais e o correspondente materno, que são as microcarúnculas estão claramente organizadas como primárias, secundárias e terciárias (criptas terminais) (SABER et al., 2008).
Em estudo sobre a morfologia da placenta a termo de jumentas da raça Martina Franca constatou-se ao exame macroscópico que o córion apresentava-se com aspecto aveludado em decorrência da presença dos vilos e sua coloração era avermelhada (CARLUCCIO et al., 2008).
Todas as placentas de jumentas da raça Martina Franca analisadas
apresentavam áreas avilosas no pólo cervical correspondente às pregas endoteliais e também no ápice do corno prenhe (correspondente à junção útero-tubárica). Placas avilosas revestidas por material espesso e viscoso de cor vermelha escura foram encontradas no ápice do corno prenhe de 90% das jumentas estudadas (CARLUCCIO et al., 2008).
Nas placentas de jumentas da raça Martina Franca o âmnion aparece como uma membrana fina e translúcida com manchas rosas amareladas em forma de vírgula além de pequenas regiões edematosas. Em 60% das placentas foram encontradas áreas arredondadas, calcificadas e de cor amarelada correspondentes ao hipomane (CARLUCCIO et al., 2008).
O peso total das membranas fetais de jumentas da raça Martina Franca foi, em média, de 2.3 kg. Verificou-se semelhança na relação entre o peso do recém-nascido e da mãe, tanto em jumentas dessa raça, quanto em éguas, cujos valores são de 9,4% e 9,3%, respectivamente; quanto a relação entre o peso da placenta e o peso do recémnascido, esta é de 12% para a jumenta e 11% para a égua, apesar da gestação da jumenta ser mais longa e o desenvolvimento de seus vilos placentários ser maior.
Esses achados sugerem que a unidade concepto/placenta poderia ser menos eficiente em jumenta quando comparada com a égua, sendo necessário maior tempo de gestação para o completo desenvolvimento do feto (CARLUCCIO et al., 2008).
Histologicamente, a placenta da jumenta da raça Martina Franca é caracterizada por um grande número de vilos nos cornos uterinos e principalmente no corpo do utero. O complexo desenvolvimento dos vilos placentários nas jumentas pode estar relacionado com o longo período de gestação desses animais (CARLUCCIO et al., 2008).
A placenta da jumenta da raça Martina Franca e da égua quando observadas à microscopia de luz, revelam-se estruturalmente similares. Os vilos são organizados em microcotilédones difusos sobre toda a face do alantocórion. A placentação é não invasiva e classificada como sendo epiteliocorial. A interdigitação feto-maternal na jumenta consiste em distintas ramificações de vilos e criptas que formam os microplacentônios (CARLUCCIO et al., 2008).
Ao observar histologicamente a placenta da jumenta, (SABER et al., 2008) verificaram a interdigitação do microcotilédone coriônico com a parte microcaruncular materna, formando o microplacentônio (microplacentoma). Na base do microcotilédone observaram ramos de arteríolas e vênulas, vasos estes que também foram observados nos ramos dos vilos intermediados por trofoblasto. Circundando o tecido fetal encontrava-se epitélio materno apoiado em tecido conjuntivo.
À microscopia eletrônica de varredura da placenta a termo da égua verificou-se que as microcarúnculas, apresentavam-se como agrupamentos de formações compactas. Os limites endometriais entre as microcarúnculas mostravam-se estreitos, e, nas bases microcarunculares muitas aberturas glandulares foram verificadas. As criptas exibiam modelo de ramificação tubular radiada que se direcionavam do lúmen uterino em direção ao tecido conjuntivo que circundava as microcarúnculas, as quais apresentavam formato arredondado que apresentavam modificações quanto a forma, durante o período gestacional (MCDONALD et al., 2000).
Ultra estruturalmente, à microscopia eletrônica de varredura, o tecido epitelial materno apresentava aparência delgada em comparação ao diâmetro amplo, tortuoso e irregular dos ramos das criptas. Analisando a superfície miometrial verificava-se presença do tecido conjuntivo separando as microcarúnculas (MCDONALD et al., 2000).
O microcotilédone fetal foi caracterizado por sua altura e pela densidade dos vilos, embora alguns vilos apresentavam ramificações longas, outros poucas ramificações e, em placentas no terço final de gestação, a aparência dos vilos assemelhava-se a do período inicial de prenhes (MCDONALD et al., 2000).
III. MATERIAL E MÉTODOS
As jumentas utilizadas neste experimento permaneceram instaladas na fazenda Ipê, município de Alfredo de Castilho, estado de São Paulo.
A alimentação desses animais consistiu de pasto formado com capim Massai consorciados com estilosantes. Receberam água de poço semi-profundo, via caixas plásticas. São mineralizados com misturas específicas para equinos onde a relação cálcio e fósforo é de duas partes para uma (Ca:P – 2:1).
Utilizaram-se onze fêmeas asininas, das quais colheram-se a placenta, após sua eliminação natural e total, no momento da parição a termo, com tempo de gestação até 363 dias.
Uma dessas onze fêmeas teve a gestação acompanhada por duas vezes.
Assim, na primeira delas realizou-se operação cesariana mediante o seguinte protocolo:
A fêmea em fase final de gestação foi preparada para a cirurgia de forma
tradicional, ou seja, foi instituído jejum alimentar e hídrico de 24 e 12 horas respectivamente, após o jejum realizou-se a primeira etapa que consiste na tranquilização do animal mediante administração de xilazina a 1,0% na dosagem de 1,1 mg por quilograma de peso corpóreo, por via intravenosa e após 5 minutos efetuou-se a segunda etapa que consistiu na aplicação de éter gliceril guaiacol (EGG), na dosagem de 10g a cada 100 quilogramas de peso corporal, associado ao midazolan na dosagem de 0,1 mg por quilograma de peso corpóreo, ambos diluídos em 500 mL de soro glicosado a 5%.
Após administração da segunda etapa foi feita indução com cetamina a 10%, na dosagem de 2,0 mg por quilograma de peso corporal por via intravenosa e em seguida, manutenção anestésica com halotano a volume 3%. Ato contínuo procedeu-se a tricotomia da região abdominal, antissepsia e laparotomia por via pré-retroumbilical na linha mediana de forma convencional. Logo após o útero gestante foi exposto e realizou-se a histerotomia com consequente retirada do feto, além da colheita de segmento da interação materno-fetal para análise. Parte dos fragmentos da interação materno-fetal colhidos foram fixados para posterior processamento usual em histologia e, outra parte, fixada e processada para análise à microscopia eletrônica de varredura.
A histerorrafia foi realizada em dois planos utilizando categute cromado número 2 e com sutura de Schimiedem seguida da Cushing. A laparorrafia e a dermorrafia foram feitas com fios inabsorvíveis de nylon. Os cuidados pós operatórios foram diários e constaram de limpeza da ferida cirúrgica com solução fisiológica e iodo povidine, além de antibioticoterapia por sete dias, mediante administração de penicilina na dosagem de 20.000 UI por quilograma de peso corporal.
A cirurgia foi realizada no Hospital Veterinário “Governador Laudo Natel” da Faculdade de Ciências Agrárias e Veterinárias da UNESP e lá permaneceu por 48 horas após a cirurgia.
Após seu restabelecimento, essa fêmea foi inseminada e teve sua gestação monitorada até o momento da parição, ocasião em que ocorreu parto normal e liberação da placenta que foi colhida na íntegra, para análise.
Em todas as onze placentas, inicialmente foram observados os seguintes parâmetros: peso, integridade macroscópica, espessura e sanidade de cada uma, individualmente.
Fragmentos placentários foram colhidos e, para o estudo histológico, juntamente com alguns segmentos da interação materno fetal foram fixados em solução de Bouin e, posteriormente, incluídos em paraplast (Histosec® - Merck) mediante realização de rotina histológica convencional seguida da microtomia em micrótomo automático (Leica - RM2155), com auxílio de navalhas descartáveis. Cortes de cinco micrômetros foram corados em Hematoxilina e Eosina (HE) e Tricrômio de Masson (TM) e azul de toluidina de acordo com as técnicas descritas por TOLOSA et al. (2003) e JUNQUEIRA & CARNEIRO (2004).
As preparações histológicas foram analisadas em fotomicroscópio (Leica, DM5000 B) ao qual está acoplada a câmera Leica DFC300FX pela qual capturaram-se algumas imagens para a documentação. Todos os procedimentos foram efetuados no Setor de Microscopia do Laboratório de Anatomia do Departamento de Morfologia e Fisiologia Animal da Faculdade de Ciências Agrárias e Veterinárias, Câmpus de Jaboticabal, UNESP.
Para o estudo ultraestrutural, seguindo metodologia estabelecida pelo
Laboratório de Microscopia Eletrônica da FCAV/UNESP, as amostras colhidas, isto é, alguns fragmentos placentários e da interação materno-fetal foram fixados em solução de glutaraldeído a 2,5% em tampão fosfato (0,1M, pH 7,4) por 48 horas, lavadas em tampão fosfato, tratadas com ósmio a 1% , lavadas novamente em tampão fosfato, desidratadas em série crescente de alcoóis (30 a 100%), durante pelo menos 20 min cada etapa, secas ao ponto crítico no aparelho EMS® 850, metalizadas com átomos de ouro em aparelho DESK II ® (DESK II DETON VACCUN NJ, EUA) e examinadas ao microscópio eletrônico de varredura JEOL ® (JEOL® -JSM 5410 Tokyo-Japão), operando com feixe de elétrons de 15 keV, onde, alguns espécimes foram documentados.
IV. RESULTADOS
IV.1. Aspectos macroscópicos das placentas de jumentas adultas da raça Pêga Na análise macroscópica das placentas das jumentas verificou-se que o arranjo das membranas fetais era do tipo córion-alantóide, o córion apóia-se no endométrio uterino com exceção de uma pequena área denominada estrela cervical. Os microcotilédones formam-se em toda a área de interação com o endométrio caracterizando uma placentação difusa. O componente coriônico dos microcotilédones são os vilos coriônicos que aparecem como um tecido aveludado e avermelhado, caracterizando a face externa da membrana córion-alantóide. A face alantóica, que é a face interna dessa membrana é lisa de coloração azulada onde se evidenciavam os vasos sanguíneos fetais. O amniôn apresenta-se como uma membrana fina translúcida.
Em todas as peças examinadas verificou-se uma estrutura sólida irregular de cor marrom, o hipomane, mergulhada no líquido alantóico (Figuras 1 e 2).
Também no momento do parto foram registrados a idade, peso e período de gestação de cada uma das jumentas estudadas, bem como o peso e o sexo dos neonatos, além do peso das respectivas placentas (Tabela 1).
A equivalência percentual entre as médias dos pesos das jumentas, dos neonatos e das placentas estão registrados na Tabela 2.
IV.2. Aspectos microscópicos das placentas de jumentas adultas da
raça Pêga
A placenta da jumenta é classificada como difusa, pois caracteriza-se pela ligação entre a membrana córion-alantóide e o endométrio por meio dos vilos coriônicos que se interdigitam com as criptas endometriais, formando estruturas de distribuição difusa denominadas microplacentônios (Figuras 3 e 4).
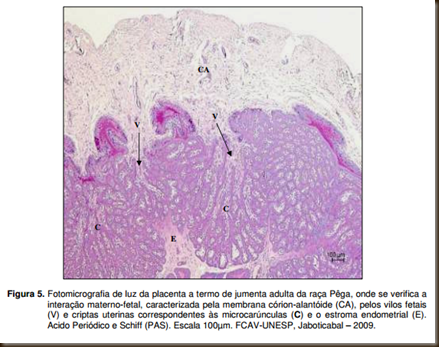
Ao microscópio de luz constatou-se que na jumenta, a interação materno-fetal, no momento da parição apresentava a porção fetal mais clara com a coloração de hematoxilina eosina, caracterizando os tufos vilosos que são formados pelos vilos e a porção materna, mais escura delimitando as criptas ou septos (Figura 5).
Entre os microplacentônios estão as aréolas, estruturas que se compõem de uma parte fetal constituída de células trofoblásticas colunares e de outra materna, sendo que nesta, abrem-se as glândulas endometriais. As porções fetal e materna da aréola estão separadas pela cavidade areolar onde as secreções das glândulas endometriais são depositadas e se acumulam (Figura 6).
Analisando-se detalhadamente a interação materno-fetal na placenta a termo de jumenta adulta da raça Pêga, constata-se que circundando o tecido fetal encontra-se o epitélio materno apoiado em tecido conjuntivo, ou seja, ocorre a interdigitação do mesênquima, onde estão os vasos fetais, com a porção materna, que se constitui pelo epitélio e estroma endometrial, local em que se situam as glândulas endometriais e os vasos maternos (Figuras 7 e 8).
Ao se analisar a membrana córion-alantóide, da porção referente ao corno uterino prenhe e não prenhe, isoladamente, verificou-se que estas estruturas, apresentavam-se semelhantes, com características de córion do tipo viloso, onde os vilos organizavam-se em tufos, formando os microcotilédones entre as aréolas.
À microscopia de luz observou-se que os vilos apresentavam estroma de tecido conjuntivo, as células trofoblásticas apresentam-se com formato variado, verifica-se epitélio cúbico, pseudoestratificado. A vascularização superficial é moderada e intensa no seu interior (Figura 9).
IV.3. Microscopia Eletrônica de Varredura da placenta (fetal) e da
interação materno-fetal de gestação a termo de jumentas adultas da raça Pêga.
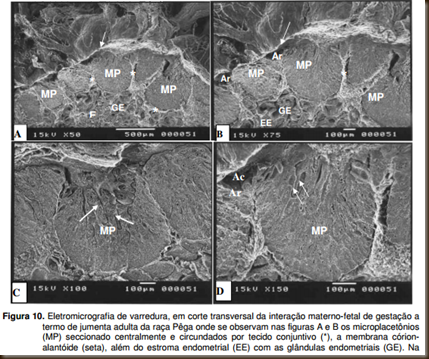
À microscopia eletrônica de varredura verificou-se na superfície de corte
transversal da região de interação materno-fetal da gestação a termo de jumenta da raça Pêga, a intrincada interdigitação dos vilos fetais com as finas estruturas das carúnculas maternas (criptas maternas) formando os microplacentônios. Essas formações são circundados por tecido conjuntivo e apresentam-se separadas por áreas referentes às aréolas. Constatou-se ainda a presença de glândulas distribuídas no estroma endometrial (Figura 10).
Verificou-se que a face externa ou materna da membrana córion-alantóide é coberta por tufos vilosos formados pelos vilos fetais intensamente ramificados (Figura 11)
V. DISCUSSÃO
Analisando a placenta da jumenta adulta da raça Pêga observou-se a presença do tecido fetal justapondo-se ao tecido materno, além de intensa vascularização placentária e assim considerou-se, analogamente a WIMSATT (1962), avaliar a palavra placenta como uma aposição funcional entre os tecidos maternos e fetais.
Nessas jumentas a estruturação dos tecidos maternos e fetais caracteriza sua placenta como córion-alantoide, da mesma forma que ocorre nos equinos e carnívoros (SCHWARZE E SCHRÖDER, 1970; ALMEIDA, 1999; ABD ELNAEIM et al.2006; MOORE, & PERSAUD, 2008).
Pôde-se verificar ainda, que na placenta das jumentas Pêga, a composição dos tecidos maternos e fetais determinava uma junção focalizada, onde as áreas vilosas do córion-alantóide ligavam-se ao endométrio de forma difusa, constituindo os microplacentônios (microplacentomas); dessa forma, classifica-se a placenta desses animais como difusa, tal qual a dos equinos e suínos ((STRAHL, 1906 ; GROSSER, 1927, WIMSATT, 1962; SCHWARZE E SCHRÖDER, 1970; RAMSEY, 1982; NODEN & DE LAHUNTA ,1990; LEISER E KAUFMANN, 1994; LEME DOS SANTOS, 1996; EURELL, 2004; HAFEZ, 2004; ABD ELNAEIM et al., 2006) e também da jumenta Eastern Kiang (NOWAK , 1999) e da jumenta selvagem da Somália (BENIRSCHKE, 2004).
Entretanto, não se verificou na placenta da jumenta grandes espaços de córion liso, ou apenas pequenas distâncias entre as vilosidades placentárias conforme relatos de BENIRSCHKE (2004) para a jumenta Eastern Kiang e de ABD ELNAEIM et al. (2006) para a placenta a termo de éguas jovens primíparas. Na jumenta Pêga ocorre apenas uma pequena área avilosa, denominada estrela cervical, da mesma forma que se observa na placenta a termo de éguas (GINTHER, 1992).
Macroscopicamente, a face córion-alantóide (face materna) da placenta da jumenta Pêga apresentava-se com aspecto aveludado e coloração avermelhada; tais observações também foram exaradas por CARLUCCIO et al. (2008) em estudo sobre a morfologia da placenta a termo de jumentas da raça Martina Franca; provavelmente, a presença dos vilos coriônicos determinava esse aspecto aveludado (CARLUCCIO et al., 2008).
Em todas as peças ora examinadas constatou-se a presença de hipomanes mergulhados no líquido alantóico, como relatado para os equídeos(WHITWELL & JEFFCOTT, 1975) e observado na jumenta selvagem da Somália (BENIRSCHKE, 2004) e na jumenta da raça Martina Franca (CARLUCCIO et al., 2008).
Na jumenta da raça Pêga, o alantocórion correspondente à face interna ou fetal do córion e apresentava-se como uma membrana lisa de coloração azulada onde se evidenciavam os vasos sanguíneos fetais à semelhança das observações de BENIRSCHKE (2004) que ao descrever as membranas fetais da jumenta selvagem da Somália afirmou que a membrana alantóica continha grande número de vasos sangüíneos.
A relação percentual entre as médias dos pesos das jumentas versus neonatos, das jumentas versus placentas e das placentas versus neonatos, na raça Pêga, encontrados nessa oportunidade, assemelham-se aos mesmos valores descritos por CARLUCCIO et al. (2008) para a raça Martina Franca.
Entretanto, CARLUCCIO et al. (2008) aludem ao fato de que a relação entre o peso da placenta e o peso do recém-nascido é de 12% para a jumenta e 11% para a égua, apesar da gestação da jumenta ser mais longa e o desenvolvimento de seus vilos placentários serem maiores, sugerindo que a unidade concepto/placenta poderia ser menos eficiente em jumenta quando comparada com a égua, sendo necessário maior tempo de gestação para o completo desenvolvimento do feto.
Quanto às observações de CARLUCCIO et al. (2008) é imprescindível considerar que entre os mamíferos, a grande gama de atividades placentárias realizamse por meio de um complexo formado por órgãos especializados, os quais se desenvolvem, concorrentemente, em sequência cronológica ou funcional; este padrão varia amplamente nas diferentes espécies, podendo ocorrer a presença de órgãos placentários específicos, funcionalmente ativos por toda, ou só em parte da gestação e que também suas funções podem ser alteradas no decorrer da prenhez, concluindo-se que estas e outras permutações são responsáveis pela incrível complexidade anatômica e fisiológica da placenta entre os mamíferos (WIMSATT, 1962).
Ao microscópio de luz constatou-se que na interação materno-fetal de gestação a termo de jumenta adulta da raça Pêga, a interdigitação dos vilos coriônicos (fetais) com as criptas endometriais (maternas) ocorre sem que haja a invasão do útero pelo trofoblasto, comprovando que para essa espécie, a placentação é não invasiva, sendo classificada, segundo LEISER & KAUFMANN (1994), como do tipo epiteliocorial; o que também foi observado, para a égua (RAMSEY, 1982), para a jumenta Eastern Kiang (NOWAK, 1999), para a jumenta selvagem da Somália (BENIRSCHKE, 2004), para a jumenta da raça Martina Franca (CARLUCCIO et al. 2008), e para a placenta da jumenta de raça indeterminada (SABER et al.,2008).
Mais detalhadamente, à microscopia de luz, verificou-se que os vilos coriônicos determinam os tufos vilosos, os quais se interdigitam às criptas maternas formando os microplacentônios (microplacentomas) entre as áreas areolares (RAMSEY, 1982), que correspondem ao local onde se abrem as glândulas endometriais, cujas secreções preenchem o espaço areolar, sob a arcada fetal - elevações do trofoblasto (GINTER, 1992; EURELL, 2004). Essas observações corroboram às descrições de SABER et al. (2008) que ao observarem a ultraestrutura e a microscopia de luz do sistema vascular placentário na jumenta sem raça determinada, mencionaram a presença da aréola, estrutura especializada que consiste de uma parte fetal (alantocórion) e uma parte materna, incluindo a abertura da glândula uterina, sendo essas duas partes separadas pela cavidade areolar.
Ainda, da mesma forma que SABER et al. (2008) verificaram para jumentas de raça não especificada, também se observou na placenta da jumenta da raça Pêga ramos de arteríolas e vênulas na base do microcotilédone e nos ramos dos vilos, sendo esses vasos entremeados por trofoblasto. Circundando o tecido fetal, encontrava-se epitélio materno apoiado em tecido conjuntivo. Analisando a placenta à termo da jumenta da raça Pêga à microscopia eletrônica de varredura, verificou-se minuciosamente a organização das microcarúnculas, que se apresentavam agrupadas determinando formações compactas, as quais estavam circundadas e separadas por tecido conjuntivo, da mesma forma que MCDONALD et al. (2000) descreveram para a placenta a termo da égua. Enfim, mediante as observações ora verificadas para a jumenta da raça Pêga, pode-se concordar com as colocações de STEVEN (1982); LEISER & KAUFMANN, (1994); WOODING E FLINT (1994); ALLEN E SHORT (1997) e ABD-ELNAEIM et al. (2006), quando afirmaram que a placenta de éguas e jumentas são estruturalmente semelhantes, sendo consideradas como difusa, epiteliocorial e microcotiledonária.
Embora a estrutura das placentas de égua e jumentas se assemelhem muito, notam-se entre essas duas espécies diferenças quanto ao tempo de gestação, peso da placenta e peso dos neonatos fatos que exigem estudos mais específicos e detalhados, principalmente ao se atentar às conclusões de LEISER e KAUFMANN (1994) de quão extraordinária é a variabilidade de estruturas placentárias desenvolvidas durante a evolução, nas diferentes espécies de mamíferos para cumprir sua meta principal, isto é, as trocas materno-fetais.
VI. CONCLUSÕES
Mediante os resultados obtidos e a forma em que foi desenvolvida esta pesquisa pode-se concluir que:
A placenta da jumenta da raça Pêga é do tipo córion-alantóide;
A placenta da jumenta da raça Pêga é classificada como difusa e epiteliocorial;
Nos jumentos da raça Pêga, a relação percentual do peso da placenta ao peso da mãe, do peso do neonato ao peso da mãe e do peso da placenta ao peso do neonato foi respectivamente, de: 1,10%, 8,36% e 13,18%.
Na jumenta ocorre pequena área avilosa, denominada estrela cervical.
Presença de hipomanes em todas as placentas.
Presença de áreas areolares onde se abrem as glândulas endometriais.
A placenta da égua e da jumenta são estruturalmente semelhantes.
Fonte: Carmen Zilda Pereira de Toledo, http://www.fcav.unesp.br/download/pgtrabs/cir/m/2775.pdf